Odeurs de moisissures, goûts terreux ou autres mauvais goûts manifestes que l’on trouve dans les vins et que l’on appelle souvent à tort et par facilité des « goûts de bouchons », sont au cœur de la thèse de doctorat de Stéphane La Guerche (Institut d’œnologie de Bordeaux). En identifiant la géosmine, le champignon responsable de ces déviances organoleptiques, il met en évidence l’origine microbienne de ces défauts, révélant l’émergence dans nos vignobles, de diverses espèces de champignons considérés jusqu’à présent comme marginaux, mais qui participent au développement des altérations du vin. Si la fermentation alcoolique permet la dégradation de certains de ces composés, d’autres défauts, notamment ceux liés à la géosmine, persistent et portent un préjudice durable à la qualité des vins. Cette étude, Grand Prix 2005 de l’académie Amorim, apporte donc un nouvel éclairage sur la qualité de nos cépages et permet d’imaginer de futurs moyens de lutte contre les déviances organoleptiques dues à la géosmine. (Robert Tinlot, président de l’académie Amorim).
La récolte de vendanges botrytisées, marquées par des odeurs fongiques ou moisies n’est pas un phénomène récent (Bayonove, 1989 ; Ribéreau-Gayon & Peynaud, 1964). Cependant, au cours de ces dernières années, plusieurs défauts aromatiques à caractère fongique, moisi ou terreux associés au développement plus ou moins visible de pourritures sur les raisins ont été mis en évidence dans des vins de différentes régions viticoles (Bordelais, Beaujolais, Val de Loire, Bourgogne).
Les premiers travaux ont permis d’identifier dans les vins un composé présentant une forte odeur de terre humide, de betterave. Il s’agit de la (-)-géosmine, un composé bien connu comme polluant de l’eau (Gerber, 1979). Ce composé est retrouvé dans des moûts avant fermentation et sa présence est toujours associée à la récolte de vendanges au moins partiellement touchées par la pourriture grise (Darriet et al., 2000 ; Darriet et al., 2001).
Toutefois, la géosmine n’est pas le seul composé responsable du caractère moisi terreux des vins. D’autres défauts terreux sont également apparus dans de grandes appellations du vignoble bourguignon.
L’importance des préjudices causés par ces problèmes sur la qualité des vins de nombreux cépages (Cabernet Sauvignon, Sémillon, Gamay, Chenin, Pinot noir) a donc motivé une étude approfondie visant, d’une part, à caractériser la nature des défauts associés à ces odeurs fongiques ou terreuses et, d’autre part, à préciser leur origine biologique et les conditions de leur expression au vignoble.
Caractérisation de défauts fongiques et/ou terreux sur les raisins, dans les moûts et dans les vins
Deux types de défauts fongiques et/ou terreux peuvent être à l’origine de déviations organoleptiques. Certains sont retrouvés au niveau des raisins et des moûts, mais ne sont pas perçus dans les vins. D’autres, en revanche, sont présents dans les raisins et les moûts et vont persister après fermentation et nuire à la qualité du vin. Une bonne connaissance de la nature chimique des composés responsables de tels défauts est donc essentielle à la compréhension de leur origine au vignoble.
Identification de défauts fongiques/terreux présents dans les raisins et les moûts
Des raisins, jus de raisins et vins issus de cépages Cabernet Sauvignon, Gamay, Pinot, Sémillon obtenus à partir de raisins touchés au moins partiellement par la pourriture grise et marqués par des caractères fongiques et terreux ont donc été analysés par chromatographie en phase gazeuse couplée à un mode de détection olfactométrique (CPG-O). Cette technique a permis de mettre en évidence les zones odorantes les plus caractéristiques, puis les composés correspondants ont été identifiés.
Une assez grande diversité des zones odorantes correspondant à des odeurs fongiques et terreuses peut être détectée (tableau 1) [La Guerche et al., 2003b]. La présence de ces composés est variable selon la nature du cépage, le stade de développement et le type de pourriture des baies. Parmi les composés fréquemment identifiés, le 1-octen-3-ol, la 1-octen-3-one, le 2-octen-1-ol et le 2-heptanol sont systématiquement associés aux odeurs de champignon présentes dans les raisins touchés par la pourriture grise. Ces composés sont les métabolites synthétisés par de nombreuses espèces fongiques (Tressl et al., 1982).
 D’autres composés possédant des notes camphrées et terreuses ont aussi été identifiés soit dans des raisins blancs (Sémillon, Sauvignon), soit dans des raisins noirs (Cabernet Sauvignon, Pinot noir, Gamay) issus de vendanges récoltées après développement de pourriture grise due à Botrytis cinerea. Il s’agit du fenchol, de la fenchone, et du 2-methylisoborneol. Ce dernier paraît être, parmi les composés à odeur terreuse, le principal responsable du défaut moisi terreux des raisins noirs atteints par B. cinerea.
D’autres composés possédant des notes camphrées et terreuses ont aussi été identifiés soit dans des raisins blancs (Sémillon, Sauvignon), soit dans des raisins noirs (Cabernet Sauvignon, Pinot noir, Gamay) issus de vendanges récoltées après développement de pourriture grise due à Botrytis cinerea. Il s’agit du fenchol, de la fenchone, et du 2-methylisoborneol. Ce dernier paraît être, parmi les composés à odeur terreuse, le principal responsable du défaut moisi terreux des raisins noirs atteints par B. cinerea.


Etude de propriétés physico-chimiques de la (-)-géosmine
La (-)-géosmine présente des seuils de perception de 10 ng/L dans l’eau, de 40 ng/L en solution modèle de composition proche du vin, de 40-50 ng/L dans un vin blanc et de 50-80 ng/L dans un vin rouge (seuils déterminés à la Faculté d’Oenologie de Bordeaux). C’est donc un composé très odorant. Son évolution en cours de fermentation alcoolique et pendant la conservation en solution modèle proche du vin a donc été étudiée.
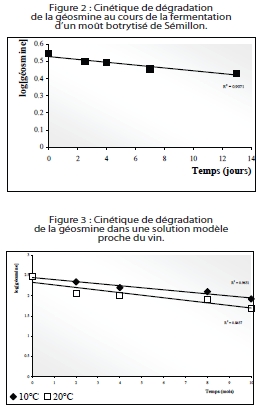

Vu la stabilité de ce composé, de nombreux essais de traitements curatifs ont été réalisés afin d’éliminer la géosmine dans les vins (tableau 2). Le lait entier permet d’éliminer jusqu’à 60 % des teneurs en géosmine d’un vin et l’huile de pépin de raisin jusqu’à 80 %. Les traitements aux corps gras présentent donc une bonne efficacité vis-à-vis de la géosmine. Cependant, à l’heure actuelle, ils ne sont pas autorisés en œnologie. De plus, un traitement thermique à 70 °C pendant 24 heures en bouteille fermée conduit à la dégradation de 80 % de la géosmine. La volatilisation sous flux d’azote ou d’argon a également été envisagée, à différentes températures, mais n’a donné aucun résultat satisfaisant.
Malgré une efficacité relative, ces traitements curatifs ne sont pas sélectifs vis-à-vis de la géosmine et engendrent des pertes d’arômes importantes dans les vins traités. Ils ne constituent donc qu’une mesure d’urgence et pas une solution durable. La maîtrise de ce problème passe donc par la prévention.

Origine de la géosmine, un composé responsable d’un arôme terreux dans les vins
Caractérisation des microorganismes associés à la genèse de géosmine au vignoble
L’origine biologique de la géosmine est attestée depuis les travaux de Gerber et Lechevalier (1965). Ce composé a été initialement mis en évidence dans des cultures de bactéries Actinomycètes (Streptomyces sp.), puis sa production par des algues bleues (Blevins et al., 1995 ; Saadoun et al., 2001) et diverses espèces de Penicillium sp. (Börjesson et al., 1993; Larsen & Frisvad, 1995 ; Mattheis & Roberts, 1992 ; Pisarnitskii & Egorov, 1988) a été démontrée.
La géosmine n’a jamais été détectée dans les raisins sains issus de parcelles touchées par ce problème, ce qui signifie que la présence de ce composé est systématiquement associée à la pourriture des raisins. A partir d’octobre 1999, de nombreux isolements de microorganismes ont donc été effectués sur des raisins sains et sur des raisins touchés par la pourriture issus de nombreuses parcelles du vignoble bordelais, du Val de Loire, de Bourgogne et du Beaujolais concernées par le problème de géosmine et de cépages blancs et noirs (Cabernet Sauvignon, Sémillon, Gamay, Chenin, Pinot noir). La microflore des baies a été analysée et l’aptitude des microorganismes isolés à produire de la géosmine a été évaluée (La Guerche et al., 2003a). Les principaux suspects pouvant être à l’origine de la genèse de géosmine au vignoble ont été caractérisés grâce aux outils de la biologie moléculaire.
Analyse de la microflore des grappes


Concernant spécifiquement les grappes présentant une odeur terreuse due à la géosmine, le genre Penicillium est bien représenté (tableau 4). De nombreuses espèces sont ponctuellement présentes, avec moins de 5 isolats par parcelle, suivant le site et l’année. Il s’agit de P. thomii, P. purpurogenum, P. frequentans, P. stoloniferum et P. carneum. Quel que soit le site, aucun d’entre eux n’est retrouvé de manière systématique durant les trois années suivies. En revanche, une seule espèce, P. expansum, caractérisée par biologie moléculaire, est toujours retrouvée sur les grappes contenant de la géosmine, sur toutes les parcelles concernées et durant toutes les années de prélèvement, avec en moyenne 5 à 10 isolats par parcelle pour les 4 sites bordelais étudiés de 1999 à 2004 et des fréquences élevées dans les autres vignobles français.
Quelques isolats de Streptomyces sp. appartenant à trois espèces majoritaires identifiées par biologie moléculaire ont été ponctuellement retrouvés sur les parcelles, mais la présence d’une espèce de Streptomyces sp. n’a jamais été répétée tous les ans sur un même site.
B. cinerea, l’agent de la pourriture grise, est omniprésent et se trouve en quantité relativement abondante tous les ans et sur tous les sites étudiés, avec plus de 10 isolats par parcelle.
De nombreux champignons et levures sont également présents sur les baies saines. Parmi les moisissures, nous avons rencontré le plus fréquemment Aureobasidium pullulans et plusieurs espèces d’Alternaria spp. B. cinerea, Cladosporium sp. et Epicoccum nigrum sont également bien représentés. Parmi les levures observées, Rhodotorula sp. est systématiquement retrouvée. D’autres champignons sont révélés plus ponctuellement : Penicillium spp., Aspergillus niger, Coniothyrium sp., Phoma sp., Cephalosporium sp., Pestalotia sp. et Chaetomium sp.
Aptitude des microorganismes à produire la géosmine
Les potentialités de production de la géosmine par les représentants de la microflore précédemment mis en évidence ont ensuite été évaluées, après culture sur boîte de Petri et extraction des composés volatils, par chromatographie en phase gazeuse couplée à la spectrométrie de masse. Deux milieux de culture ont été utilisés : le milieu Malt Agar (MA) et le milieu Czapek (CZA).
Sur milieu MA, aucune des souches de B. cinerea testées ne produit la géosmine, mais certains isolats synthétisent un autre composé à odeur terreuse et camphrée (tableau 5). Parmi les Penicillium spp. isolés, seuls les représentants de deux espèces phénotypiquement caractérisées produisent de la géosmine sur milieu MA. Il s’agit de P. expansum, retrouvée sur tous les sites, et de P. carneum, ponctuellement retrouvé. Les autres Penicillium spp. isolés ne produisent pas la géosmine, malgré leur aptitude à synthétiser des odeurs variées (champignon, cave) sur milieu MA. Les Streptomyces spp., isolés très ponctuellement des baies pourries provenant des différentes parcelles étudiées, produisent l’odeur terreuse caractéristique de la géosmine sur milieu MA.

Sur milieu CZA, les odeurs et composés produits par les représentants de la microflore sont identiques à ceux synthétisés sur milieu MA.
Aucun des autres champignon testés ne produits de géosmine, ni sur milieu MA, ni sur milieu CZA.
L’analyse de la microflore des baies de raisin saines ou pourries a ainsi permis de mettre en évidence l’omniprésence et l’abondance de B. cinerea sur les grappes contenant de la géosmine. De plus, en association avec ce dernier, P. expansum est systématiquement retrouvé tous les ans sur toutes les parcelles concernées par le problème de géosmine. Ce champignon et la bactérie du sol Streptomyces sp. sont capables de produire la géosmine. Nous avons donc débuté l’étude de leur métabolisme de production de la géosmine en fonction du temps et du milieu de culture.
Etude préliminaire du métabolisme de production de P. expansum et de Streptomyces sp., potentiellement responsables de la genèse de la géosmine au vignoble
Cinq types de milieux ont été inoculés avec des isolats de P. expansum ou de Streptomyces sp. : les milieux Malt Agar (MA) et « jus de raisin » (JR), à des pH allant de 3 à 7, des grappes entières, des baies de raisin et des rafles.
Les bactéries filamenteuses produisent la géosmine sur milieu MA et JR à pH supérieur à 6, mais ne peuvent se développer sur le substrat acide que constitue la baie, le jus de raisin ou la rafle (pH 3-4). L’hypothèse qu’ils puissent être impliqués dans la genèse de la géosmine au vignoble, se produisant au moment de la maturité du raisin, peut donc être écartée. Les travaux se sont donc concentrés sur P. expansum.
Paradoxalement, P. expansum se développe et produit de la géosmine sur milieu MA, quel que soit le pH, alors que sur jus de raisin sain et sur baies, le champignon croît mais la synthèse de géosmine n’est pas possible. Le métabolisme de production de ce composé par P. expansum a donc été étudié.
Etude du métabolisme de production de la géosmine par P. expansum
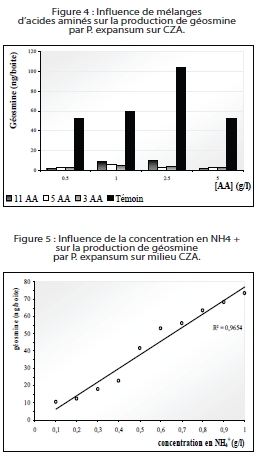
Dans un premier temps, l’étude métabolique s’est intéressée à l’influence de l’environnement et de la composition du jus de raisin sur la production de géosmine par P. expansum. Pour cela, le champignon a d’abord été ensemencé sur boîtes de Petri contenant les milieux Malt Agar (MA) ou jus de raisin (JR) en faisant varier quelques facteurs abiotiques, à savoir le niveau d’intensité lumineuse, de température et de concentration en oxygène, afin de se placer dans les conditions les plus proches possibles de celles observées au vignoble. Ensuite, divers traitements ont été appliqués sur des jus de raisin afin d’évaluer leur éventuelle influence, activatrice ou inhibitrice, sur la production de géosmine par P. expansum (pH, polyphénols, acides gras), puis nous avons particulièrement étudié l’incidence de la composition azotée du milieu de culture. Enfin, une approche biochimique de la voie de biosynthèse de la géosmine a été envisagée.
Parmi les facteurs environnementaux, seule la concentration en oxygène présente un effet stimulateur de la genèse de géosmine par P. expansum sur milieu MA, mais aucun des facteurs liés à l’environnement n’a d’effet direct sur le déclenchement de la production de géosmine du champignon.

Une approche biochimique des mécanismes de biosynthèse de la géosmine chez P. expansum a été menée afin d’identifier des produits intermédiaires de cette voie. L’efficacité d’inhibiteurs d’enzymes clés a aussi été testée, ainsi que l’incidence de la supplémentation de substrats de la voie de synthèse des terpènoïdes. Cette étude a, entre autres, permis de démontrer que la présence de géosmine dans les milieux de culture de P. expansum était associée à celle du D-germacrène, un intermédiaire récemment décrit de la voie de biosynthèse de la géosmine.
Influence de Botrytis cinerea sur la production de géosmine par P. expansum
L’observation du phénomène au vignoble a permis de mettre en évidence que les grappes pourries contenant de la géosmine présentaient systématiquement, en association avec P. expansum, des foyers de pourriture dus à B. cinerea. Par ailleurs, il a été démontré que la carence azotée du jus de raisin avait un effet inducteur sur la production de géosmine par P. expansum, carence que B. cinerea est capable de générer lors de son développement sur la baie.
Nous nous sommes donc intéressés à l’influence de B. cinerea sur la synthèse de géosmine par P. expansum à travers deux démarches complémentaires, en étudiant d’abord le complexe B. cinerea/P. expansum dans des expériences de co-inoculations sur raisin, rafle ou jus de raisin, puis en évaluant plus précisément le rôle du métabolisme de B. cinerea sur le raisin.
Importance de l’association B. cinerea / P. expansum dans la genèse de géosmine sur jus et broyat de raisin
De nombreuses expériences de co-inoculations des champignons B. cinerea et P. expansum ont été réalisées sur grappe entière, sur baies, sur rafle, sur broyat de raisin et sur jus de raisin. Différents cépages, isolats, conditions environnementales et délais entre inoculations ont été testés.
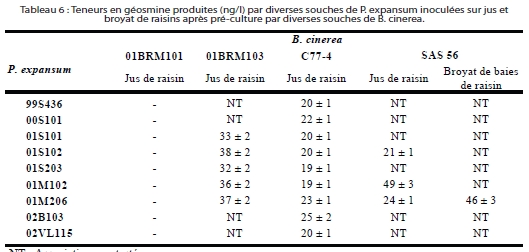


L’action essentielle de B. cinerea s’interprète donc par la dégradation des acides aminés, inhibiteurs de cette genèse. De plus, le mannitol, un polyol produit par B. cinerea, permet également à P. expansum de produire ce composé. Il pourrait donc avoir un rôle stimulateur sur la genèse de géosmine.
Interprétation de la variabilité intraspécifique de B. cinerea dans son aptitude à préparer le raisin pour la synthèse de géosmine par P. expansum
Après avoir mis en évidence le rôle joué par l’association entre les deux champignons que sont B. cinerea et P. expansum dans la genèse de la géosmine au vignoble, nous avons démontré que le métabolisme de certaines souches de B. cinerea pouvait influer de manière positive sur l’expression de géosmine par P. expansum. Nous avons donc cherché à savoir quelle(s) différence(s) pouvaient exister entre les quelques souches de B. cinerea dites « favorables » à la genèse de géosmine par P. expansum sur jus de raisin (nommées « bot + ») et celles dites « non favorables » (nommées « bot – »).
Les concentrations en acides aminés, ion ammonium et mannitol de plusieurs jus de raisin pré-cultivés avec des souches « bot + » ou « bot – » ont été comparées. Aucune différence n’a été observée.
La nature activatrice des souches « bot + » ou inhibitrice des souches « bot – » a été évaluée par culture de P. expansum sur différents mélanges de jus pré-cultivés (de 0 % bot – / 100 % bot + à 100 % bot – / 0 % bot +). La genèse de géosmine par le champignon est inhibée pour un pourcentage de jus pré-cultivé par une souche « bot – » de B. cinerea supérieur ou égal à 5 %. Les souches « bot – » synthétisent donc un composé inhibiteur de la production de géosmine par P. expansum.
Des étapes de purification ont ensuite permis de déterminer quelques caractéristiques de ce(s) composé(s) inhibiteur(s) : il(s) est(sont) thermorésistant(s), acide(s), de taille comprise entre 30 et 50 kDa et de nature polysaccharidique. La caractérisation de ce(s) composé(s) se poursuit par des techniques de chromatographie liquide haute performance.
Ces résultats suggèrent donc que toutes les souches de B. cinerea possèdent la capacité à « préparer » le jus de raisin, en en modifiant spécialement le contenu aminé, pour permettre à P. expansum de produire la géosmine mais que la grande majorité des souches de B. cinerea synthétisent simultanément un inhibiteur de cette genèse.
Conclusion
En conclusion, ce travail a contribué à la caractérisation de défauts organoleptiques fongiques et terreux retrouvés dans les raisins, les moûts et les vins grâce aux nouveaux outils d’analyse chromatographique et à la sensibilité accrue des détecteurs de masse. Si la fermentation alcoolique permet la dégradation de certains de ces composés, d’autres défauts, notamment ceux liés à la présence de la (-)-géosmine, persistent et altèrent durablement la qualité organoleptique des vins. Il a permis de démontrer l’origine microbienne de certains de ces défauts et révélé ainsi l’émergence dans nos vignobles de climats tempérés d’associations entre Botrytis cinerea et diverses espèces fongiques considérées jusqu’à présent comme marginales, notamment P. expansum.
Une étude approfondie de l’origine de la (-)-géosmine a permis d’établir la présence systématique du complexe B. cinerea – P. expansum sur les grappes contenant ce composé et la possibilité de sa genèse, sur jus et broyat de raisins, par développement successif de souches de B. cinerea puis de P. expansum. Des éléments d’explication du phénomène ont pu être apportés, qui trouvent notamment leur origine dans la carence en azote aminé du jus de raisin due au développement de B. cinerea. Ce travail a également mis en évidence une variabilité intraspécifique des populations de souches de B. cinerea dans leur aptitude à synthétiser une macromolécule polysaccharidique capable de réprimer la genèse de géosmine par P. expansum.
Une connaissance accrue non seulement de la nature chimique des défauts organoleptiques et de leur origine mais aussi de l’écologie des espèces fongiques au vignoble parait indispensable dans l’avenir pour faire face le plus rapidement et le plus efficacement possible à ces problèmes.
Bibliographie
Bayonove, C. (1989). Incidences des attaques parasitaires fongiques sur la composante qualitative du raisin et des vins. Revue Française des Oenologues 116, 29-39.
Blevins, W. T., Schrader, K. K. & Saadoun, I. (1995). Comparative physiology of geosmin production by Streptomyces halstedii and Anabaena sp. Water Science and Technology 31, 127-133.
Börjesson, T. S., Stollman, U. M. & Schnürer, J. L. (1993). Off-odorous compounds produced by molds on oatmeal agar: identification and relation to other growth characteristics. J Agric Food Chem 41, 2104-2111.
Darriet, P., Pons, M., Lamy, S. & Dubourdieu, D. (2000). Identification and quantification of geosmin, an earthy odorant contaminating wines. J Agric Food Chem 48, 4835-4838.
Darriet, P., Lamy, S., La Guerche, S., Pons, M., Dubourdieu, D., Blancard, D., Steliopoulos, P. & Mosandl, A. (2001). Stereodifferentiation of geosmin in wine. Eur Food Res Technol 213, 122-125.
Darriet, P., Pons, M., Henry, R., Dumont, O., Findeling, V., Cartolaro, P., Calonnec, A. & Dubourdieu, D. (2002). Impact odorants contributing to the fungus typa aroma from grape berries contaminated by powdery mildew (Uncinula necator) ; Incidence of enzymatic activities of the yeast Saccharomyces cerevisiae. J Agric Food Chem 50, 3277-3282.
Gerber, N. N. & Lechevalier, H. A. (1965). Geosmin, an earthly-smelling substance isolated from actinomycetes. Appl Microbiol 13, 935-938.
Gerber, N. N. (1979). Volatile substances from actinomycetes: their role in the odor pollution of water. CRC Crit Rev Microbiol 7, 191-214.
La Guerche, S., Blancard, D., Chamont, S., Dubourdieu, D. & Darriet, P. (2003a). Origine de la géosmine, composé responsable d’un arôme terreux dans les vins – étude des microorganismes impliqués et de leur métabolisme. In Œnologie 2003 – 7th International Symposium of Enology, pp. 22-25. Edited by A. Lonvaud, G. De Revel & P. Darriet. Paris: Tec & Doc.
La Guerche, S., Pons, M. & Darriet, P. (2003b). Étude de composés volatils associés à la pourriture des raisins et responsables de défauts olfactifs dans les moûts et les vins. In Œnologie 2003 – 7th International Symposium of Enology, pp. 433-436. Edited by A. Lonvaud, G. De Revel & P. Darriet. Paris: Tec & Doc.
La Guerche, S. (2004). Recherches sur les déviations organoleptiques des moûts et des vins associées au développement de pourritures sur les raisins – étude particulière de la géosmine. In Doctorat Sciences Biologiques et Médicales : Université Victor Segalen Bordeaux 2.
La Guerche, S., Chamont, S., Blancard, D., Dubourdieu, D. & Darriet, P. (2005). Origin of (-)-geosmin on grapes. On the complementary action of two fungi, Botrytis cinerea and Penicillium expansum. Antonie Van Leeuwenhoek, Sous presse.
Larsen, T. O. & Frisvad, J. C. (1995). Characterization of volatile metabolites from 47 Penicillium taxa. Mycology Research 99, 1153-1166.
Mattheis, J. P. & Roberts, R. G. (1992). Identification of geosmin as a volatile metabolite of Penicillium expansum. Appl Environ Microbiol 58, 3170-3172.
Pisarnitskii, A. F. & Egorov, I. A. (1988). Low molecular weight metabolites produced by various Penicillium species. Prikl Biokhim Mikrobiol 24, 760-764.
Ribéreau-Gayon, J. & Peynaud, E. (1964). Tome 1 : Maturation du raisin, fermentation alcoolique, vinification. Paris: Béranger.
Saadoun, I., Schrader, K. K. & Blevins, W. T. (2001). Identification of geosmin as a volatile metabolite of Anabaena sp. J Basic Microbiol 41, 51-55.
Tressl, R., Bahri, D. & Engel, K. H. (1982). Formation of eight-carbon and ten-carbon components in mushrooms (Agaricus campestris). J Agric Food Chem 30, 89-93.
Wanner, P. & Tressl, R. (1998). Purification and characterization of two enone reductases from Saccharomyces cerevisiae. Eur J Biochem 255, 271-278





